Học công thức khí lý tưởng và các định luật cơ bản trong hóa học
Công thức khí lý tưởng là nền tảng quan trọng trong hóa học và vật lý. Các phương trình trạng thái giúp dự đoán chính xác hành vi của khí. Bài viết trình bày chi tiết các định luật cơ bản kèm phương pháp giải bài tập thiết thực.
Công thức khí lý tưởng là gì?
Công thức khí lý tưởng được biểu diễn bằng phương trình:
PV = nRT
Trong đó:
- P: Áp suất của khí (đơn vị: atm hoặc Pa)
- V: Thể tích của khí (đơn vị: lít hoặc m3)
- n: Số mol khí
- R: Hằng số khí lý tưởng (R = 0,082 atm.L/mol.K)
- T: Nhiệt độ tuyệt đối (đơn vị: Kelvin)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn đơn vị của các đại lượng. Cần đặc biệt lưu ý chuyển đổi nhiệt độ từ độ C sang độ K bằng công thức:
T(K) = t(°C) + 273
Để giúp các em dễ nhớ, tôi thường ví von công thức khí lý tưởng như một phép nhân đơn giản: “Áp suất nhân thể tích bằng số mol nhân hằng số nhân nhiệt độ”.
Ví dụ thực tế: Khi bơm xe đạp, áp suất trong bơm tăng lên do thể tích giảm xuống trong khi nhiệt độ và số mol không đổi. Điều này hoàn toàn phù hợp với công thức PV = nRT.
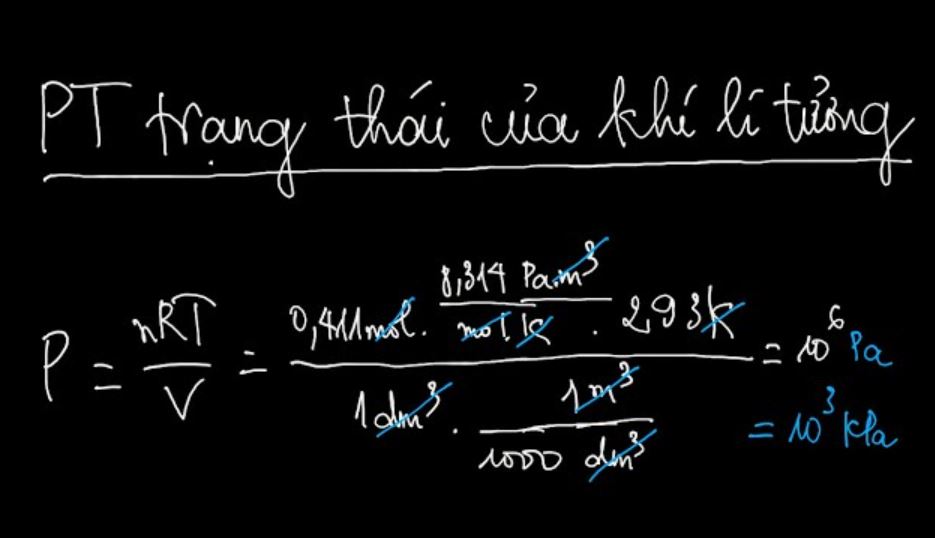
Một lưu ý quan trọng khi sử dụng công thức là các khí phải ở điều kiện lý tưởng: áp suất thấp, nhiệt độ cao và mật độ phân tử thấp.
Các điều kiện và đặc điểm của khí lý tưởng
Khí lý tưởng là mô hình lý tưởng hóa của các chất khí thực tế. Mô hình này giúp đơn giản hóa việc nghiên cứu tính chất của khí.
Để hiểu rõ hơn về khí lý tưởng và khí thực, ta cần nắm được các điều kiện và đặc điểm cơ bản của chúng.
Điều kiện để một chất khí được coi là khí lý tưởng
Một chất khí được coi là khí lý tưởng khi thỏa mãn các điều kiện sau:
Các phân tử khí chuyển động hỗn loạn không ngừng và va chạm đàn hồi hoàn toàn với nhau và thành bình.
Thể tích của các phân tử khí nhỏ không đáng kể so với thể tích bình chứa. Điều này giúp bỏ qua lực tương tác giữa các phân tử.
Các điều kiện khí lý tưởng thường đạt được ở áp suất thấp và nhiệt độ cao. Trong điều kiện này, khoảng cách giữa các phân tử đủ lớn.
So sánh khí lý tưởng và khí thực
Khí lý tưởng là mô hình lý thuyết hoàn hảo. Khí thực tồn tại các lực tương tác phân tử và thể tích phân tử không thể bỏ qua.
Khí thực tuân theo phương trình Van der Waals. Phương trình này có thêm các hệ số hiệu chỉnh cho lực tương tác và thể tích phân tử.
Ở điều kiện thường, nhiều khí như N2, O2, H2 có tính chất gần với khí lý tưởng. Các khí này thường được xem xét như khí lý tưởng.
Các đại lượng đặc trưng của khí lý tưởng
Áp suất (P) là lực tác dụng trên một đơn vị diện tích. Đơn vị thường dùng là atm, mmHg hoặc Pa.
Thể tích (V) là không gian mà khí chiếm chỗ. Đơn vị thường dùng là lít (L) hoặc mét khối (m3).
Nhiệt độ (T) đặc trưng cho mức độ chuyển động của các phân tử. Đơn vị là Kelvin (K) trong các phương trình khí lý tưởng.
Số mol (n) cho biết lượng chất khí. Một mol chứa 6,022.1023 phân tử (số Avogadro).
Phương trình trạng thái và các định luật về khí lý tưởng
Khí lý tưởng là mô hình lý tưởng hóa của các chất khí thực. Các phân tử khí không tương tác với nhau và chuyển động hoàn toàn ngẫu nhiên.
Để mô tả trạng thái của khí lý tưởng, các nhà khoa học đã thiết lập các định luật quan trọng. Chúng ta sẽ tìm hiểu từng định luật cụ thể.

Định luật Boyle-Mariotte và ứng dụng
Định luật Boyle-Mariotte phát biểu: Ở nhiệt độ không đổi, tích của áp suất và thể tích của một khối khí là hằng số.
Công thức toán học:
P1V1 = P2V2 = hằng số
Trong đó:
- P1, P2: áp suất ở trạng thái 1 và 2
- V1, V2: thể tích ở trạng thái 1 và 2
Ví dụ thực tế: Khi bơm xe đạp, thể tích khí giảm xuống làm áp suất tăng lên theo tỷ lệ nghịch.
Định luật Charles-Gay Lussac và ứng dụng
Định luật Charles-Gay Lussac bao gồm hai phần:
- Định luật Charles: V/T = hằng số (P không đổi)
- Định luật Gay-Lussac: P/T = hằng số (V không đổi)
Trong đó:
- V: thể tích khí
- T: nhiệt độ tuyệt đối
- P: áp suất
Kinh nghiệm giảng dạy cho thấy học sinh dễ nhớ hơn khi liên hệ với việc bóng bay nở to khi đặt ngoài nắng nóng.
Định luật áp suất từng phần của Dalton
Định luật áp suất từng phần phát biểu: Áp suất của hỗn hợp khí bằng tổng áp suất từng phần của các khí thành phần.
Công thức:
Ptổng = P1 + P2 + P3 + …
Áp suất từng phần Pi = xi.P
- xi: phân số mol của khí i
- P: áp suất chung của hỗn hợp
Phương trình trạng thái tổng quát của khí lý tưởng
Phương trình trạng thái khí lý tưởng có dạng:
PV = nRT
Trong đó:
- P: áp suất (atm)
- V: thể tích (lít)
- n: số mol
- R: hằng số khí (0.082 atm.L/mol.K)
- T: nhiệt độ tuyệt đối (K)
Đây là phương trình tổng hợp từ các định luật trên và được ứng dụng rộng rãi trong tính toán về khí.
Hướng dẫn giải bài tập về khí lý tưởng
Giải bài tập khí lý tưởng đòi hỏi nắm vững phương trình trạng thái và các định luật liên quan. Tôi sẽ chia sẻ kinh nghiệm giảng dạy để giúp các em tiếp cận dễ dàng hơn.
Phương trình cơ bản cần nhớ:
PV = nRT
Trong đó:
P: Áp suất (atm)
V: Thể tích (lít)
n: Số mol
R: Hằng số khí (0,082 atm.L/mol.K)
T: Nhiệt độ (K)
Các dạng bài tập thường gặp
Qua 20 năm giảng dạy, tôi nhận thấy có 3 dạng bài tập chính về khí lý tưởng:
Dạng 1: Tính các đại lượng P, V, n, T khi biết 3 đại lượng còn lại.
Dạng 2: So sánh trạng thái khí trước và sau khi thay đổi điều kiện.
Dạng 3: Xác định khối lượng phân tử, tỷ khối của khí.
Phương pháp giải và các bước làm chi tiết
Cách giải bài tập khí lý tưởng cần tuân thủ các bước sau:
Bước 1: Liệt kê đầy đủ dữ kiện đã cho và quy đổi đơn vị phù hợp.
Bước 2: Xác định dạng bài tập và công thức cần sử dụng.
Bước 3: Thay số và tính toán kết quả.
Bước 4: Kiểm tra đơn vị và độ hợp lý của kết quả.

Bài tập mẫu có lời giải
Để minh họa ứng dụng phương trình khí lý tưởng, ta xét ví dụ sau:
Bài toán: Một khí có thể tích 2,46L ở 27°C và áp suất 2atm. Tính số mol khí.
Giải:
- Quy đổi nhiệt độ: T = 27 + 273 = 300K
- Áp dụng PV = nRT
- Thay số: 2 × 2,46 = n × 0,082 × 300
- Tính được n = 0,2 mol
Kinh nghiệm của tôi là luôn kiểm tra kết quả bằng cách thế ngược lại vào phương trình ban đầu.
FAQ: Câu hỏi thường gặp về khí lý tưởng
Trong quá trình giảng dạy, tôi thường gặp nhiều câu hỏi thắc mắc về công thức khí lý tưởng. Sau đây là những câu hỏi phổ biến nhất:
- Khí lý tưởng là gì?
Khí lý tưởng là mô hình lý tưởng hóa của khí thực, trong đó các phân tử khí không tương tác với nhau và va chạm đàn hồi hoàn toàn.
- Phương trình trạng thái khí lý tưởng có dạng nào?
Phương trình có dạng: PV = nRT
Trong đó:
P: áp suất khí (Pa)
V: thể tích khí (m3)
n: số mol khí (mol)
R: hằng số khí (8,314 J/mol.K)
T: nhiệt độ tuyệt đối (K)
- Khi nào một khí được coi là khí lý tưởng?
Khí được coi là lý tưởng khi ở áp suất thấp, nhiệt độ cao so với điểm tới hạn của nó.
- Tại sao cần học về khí lý tưởng?
Mô hình khí lý tưởng giúp đơn giản hóa việc tính toán và dự đoán tính chất của khí thực trong nhiều điều kiện.
- Có thể áp dụng phương trình khí lý tưởng cho mọi loại khí không?
Không thể áp dụng cho mọi khí. Phương trình chỉ phù hợp với khí ở điều kiện gần lý tưởng.
Việc áp dụng công thức khí lý tưởng đóng vai trò nền tảng trong nghiên cứu và tính toán các quá trình hóa học. Các định luật về khí lý tưởng giúp dự đoán chính xác sự thay đổi thể tích, áp suất và nhiệt độ của khí trong điều kiện chuẩn. Những kiến thức này tạo cơ sở vững chắc cho việc giải quyết các bài toán về khí trong thực tiễn và phòng thí nghiệm.
Bài viết liên quan

Học thuộc công thức tính nhiệt nóng chảy và ứng dụng trong hóa học
Tìm hiểu công thức tính nhiệt nóng chảy và các khái niệm cơ bản về nhiệt nóng chảy riêng, đơn vị đo, bảng tra cứu các chất thông dụng. Hướng dẫn chi tiết cách tính và ứng dụng thực tế.

Công thức đoạn nhiệt khái quát và cách áp dụng trong hóa học cơ bản
Tìm hiểu chi tiết về công thức đoạn nhiệt trong hóa học với cách tính, phương pháp xác định và ứng dụng. Bài viết giải thích đơn giản các khái niệm đoạn nhiệt chuẩn, phản ứng kèm bài tập mẫu.

Điểm qua công thức tính công suất tỏa nhiệt và ứng dụng thực tế
Tìm hiểu chi tiết công thức tính công suất tỏa nhiệt trong mạch điện với các khái niệm cơ bản, công thức Q=I²Rt và ứng dụng thực tế qua bài tập có lời giải mẫu đơn giản.

Nắm kỹ công thức tính nhiệt độ tuyệt đối và cách chuyển đổi thang nhiệt
Tìm hiểu công thức tính nhiệt độ tuyệt đối và cách chuyển đổi giữa độ C, K. Giải thích chi tiết khái niệm, ứng dụng thực tế cùng bài tập minh họa về thang nhiệt Kelvin.

Học công thức đẳng nhiệt và ứng dụng trong khí lý tưởng cơ bản
Tìm hiểu chi tiết công thức đẳng nhiệt và định luật Boyle-Mariotte qua các ví dụ, bài tập có lời giải. Phân tích đồ thị, ứng dụng thực tế giúp nắm vững kiến thức cơ bản.

Điểm qua công thức đẳng áp và ứng dụng trong nhiệt động lực học
Tìm hiểu công thức đẳng áp và các đặc điểm của quá trình đẳng áp trong nhiệt động lực học. Hướng dẫn chi tiết cách tính công, ứng dụng thực tế kèm bài tập có lời giải.

