Nắm rõ công thức điện phân và ứng dụng trong hóa học cơ bản
Công thức điện phân giúp học sinh nắm vững các phản ứng oxi hóa
- khử tại điện cực. Quá trình này diễn ra theo quy luật rõ ràng với nhiều ứng dụng thực tiễn. Các phương trình điện phân cơ bản của nước, muối halogen và muối kim loại được trình bày chi tiết kèm ví dụ minh họa.
Công thức điện phân là gì?
Công thức điện phân là phương trình toán học mô tả mối quan hệ giữa khối lượng chất điện phân và các yếu tố trong quá trình điện phân. Công thức này được phát biểu bởi nhà khoa học Michael Faraday.
Công thức điện phân cơ bản có dạng:
m = (A.I.t)/(n.F)

Trong đó:
- m: khối lượng chất điện phân (g)
- A: khối lượng nguyên tử của chất điện phân (g/mol)
- I: cường độ dòng điện (A)
- t: thời gian điện phân (s)
- n: hóa trị của ion
- F: hằng số Faraday (96500 C/mol)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn giữa A và n. A là khối lượng nguyên tử, còn n là số electron trao đổi trong phản ứng điện phân.
Ví dụ điện phân dung dịch CuSO4 với điện cực trơ:
- Tại catot (-): Cu2+ + 2e → Cu
- Tại anot (+): 2H2O → O2 + 4H+ + 4e
- n = 2 (Cu2+ nhận 2e)
- A = 64 (khối lượng nguyên tử Cu)
Công thức điện phân là gì mà học sinh hay sai? Đó là việc quên đổi đơn vị thời gian từ phút sang giây trước khi thế vào công thức. Cần nhân thời gian với 60 nếu đề bài cho đơn vị phút.
Mẹo nhỏ khi sử dụng công thức: Viết sẵn các đơn vị chuẩn bên cạnh các ký hiệu để tránh nhầm lẫn khi thế số. Điều này giúp học sinh kiểm tra nhanh việc đổi đơn vị.
Nguyên lý và quy luật cơ bản của quá trình điện phân
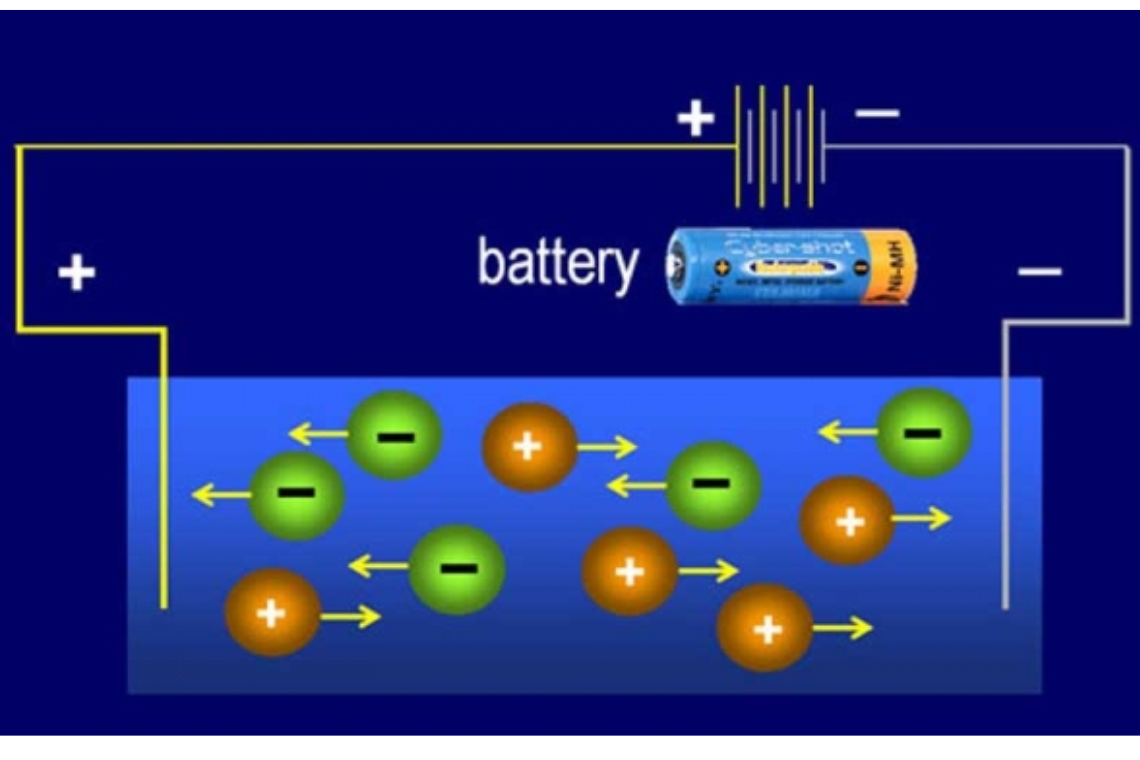
Quá trình điện phân tuân theo các quy luật điện hóa cơ bản. Khi cho dòng điện một chiều đi qua dung dịch điện ly, các ion sẽ di chuyển về các điện cực tương ứng.
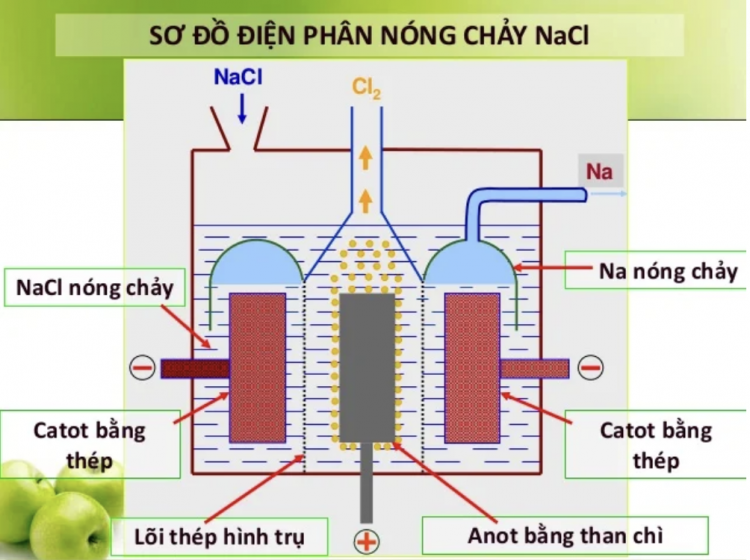
Tại catot (-), các ion dương sẽ nhận electron và bị khử thành nguyên tử hoặc phân tử trung hòa. Quá trình này liên quan mật thiết đến công thức lực điện giữa các hạt tích điện.
Tại anot (+), các ion âm sẽ nhường electron và bị oxi hóa. Công thức điện phân áp dụng định luật Faraday xác định khối lượng chất sinh ra tại điện cực.
Các yếu tố ảnh hưởng đến quá trình điện phân
Cường độ dòng điện là yếu tố quan trọng nhất, ảnh hưởng trực tiếp đến tốc độ điện phân. Điều này phụ thuộc vào công thức tính điện trở tổng của mạch điện.
Nồng độ dung dịch điện ly quyết định khả năng dẫn điện của dung dịch. Nồng độ càng lớn, điện trở càng nhỏ và quá trình điện phân diễn ra càng nhanh.
Nhiệt độ cao làm tăng độ linh động của các ion, giúp quá trình điện phân diễn ra thuận lợi hơn. Tuy nhiên cần kiểm soát nhiệt độ phù hợp để tránh bay hơi dung môi.
Thứ tự điện phân của các ion trong dung dịch
Thứ tự điện phân phụ thuộc vào thế điện cực chuẩn của các ion. Ion có thế điện cực dương hơn sẽ được điện phân trước.
Với các ion kim loại, thứ tự điện phân từ dễ đến khó là: Au3+ > Ag+ > Cu2+ > H+ > Fe2+ > Zn2+ > Al3+. Điều này giúp tách chiết kim loại có độ tinh khiết cao.
Với các ion âm, thứ tự điện phân từ dễ đến khó là: SO42
- > NO3- > Cl- > OH-. Quá trình này thường được ứng dụng trong công nghiệp điện phân muối.
Công thức điện phân các chất điển hình
Công thức điện phân là quá trình chuyển hóa hóa học dưới tác dụng của dòng điện một chiều. Quá trình này giúp phân tách các chất thành các thành phần đơn giản hơn.
Để tính toán chính xác lượng chất sinh ra tại điện cực, chúng ta cần nắm vững công thức tính nồng độ mol và các quy luật điện phân.
Công thức điện phân nước và ứng dụng
Công thức điện phân nước diễn ra theo phương trình:
2H2O → 2H2 + O2
Tại catot (-): 2H2O + 2e → H2 + 2OH-
Tại anot (+): 2H2O → O2 + 4H+ + 4e
Quá trình điện phân nước tạo ra khí hydro và oxi tinh khiết, được ứng dụng rộng rãi trong công nghiệp hóa chất.
Công thức điện phân muối halogen
Muối halogen khi điện phân sẽ tạo ra kim loại tại catot và halogen tại anot. Quá trình này đóng vai trò quan trọng trong sản xuất công nghiệp.
Điện phân natri clorua (NaCl)
Công thức điện phân natri clorua với điện cực trơ:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
Tại catot (-): 2H2O + 2e → H2 + 2OH-
Tại anot (+): 2Cl
- → Cl2 + 2e
- → Cl2 + 2e
- → Cl2 + 2e
Điện phân kali clorua (KCl)
Công thức điện phân kali clorua diễn ra tương tự NaCl:
2KCl + 2H2O → 2KOH + H2 + Cl2
Sản phẩm chính thu được là KOH, khí H2 và Cl2, được sử dụng nhiều trong công nghiệp xút-clo.
Điện phân đồng clorua (CuCl2)

Công thức điện phân đồng clorua với điện cực trơ:
CuCl2 → Cu + Cl2
Tại catot (-): Cu2+ + 2e → Cu
Tại anot (+): 2Cl- → Cl2 + 2e
Điện phân kẽm clorua (ZnCl2)
Công thức điện phân kẽm clorua với điện cực trơ:
ZnCl2 → Zn + Cl2
Tại catot (-): Zn2+ + 2e → Zn
Tại anot (+): 2Cl- → Cl2 + 2e
Công thức điện phân muối sunfat và nitrat
Muối sunfat và nitrat khi điện phân tạo ra kim loại tại catot và oxi tại anot.
Điện phân đồng sunfat (CuSO4)
Công thức điện phân đồng sunfat với điện cực trơ:
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Tại catot (-): Cu2+ + 2e → Cu
Tại anot (+): 2H2O → O2 + 4H+ + 4e
Điện phân bạc nitrat (AgNO3)
Công thức điện phân bạc nitrat với điện cực trơ:
4AgNO3 + 2H2O → 4Ag + 4HNO3 + O2
Tại catot (-): Ag+ + e → Ag
Tại anot (+): 2H2O → O2 + 4H+ + 4e
Điện phân đồng nitrat (Cu(NO3)2)
Công thức điện phân đồng nitrat với điện cực trơ:
2Cu(
Ứng dụng của điện phân trong thực tế
Quá trình điện phân đóng vai trò quan trọng trong nhiều ngành công nghiệp. Công thức điện phân giúp tính toán chính xác lượng chất điện phân và thời gian cần thiết. Việc áp dụng công thức tính điện tích cực đại và công thức tính u hiệu dụng giúp tối ưu hiệu suất quá trình điện phân.
Điện phân trong công nghiệp luyện kim
Điện phân là phương pháp hiệu quả để sản xuất kim loại từ quặng. Ví dụ điển hình là sản xuất nhôm từ quặng bauxit qua điện phân nhôm oxit nóng chảy.
Theo số liệu từ Tập đoàn Công nghiệp Than
- Khoáng sản Việt Nam, nhà máy alumin Nhân Cơ sản xuất được 650.000 tấn alumin/năm nhờ ứng dụng công nghệ điện phân hiện đại.
Quá trình điện phân trong luyện kim giúp thu được kim loại tinh khiết với độ tinh khiết cao, tiết kiệm năng lượng so với phương pháp nhiệt luyện truyền thống.
Điện phân trong mạ điện
Mạ điện là quá trình phủ một lớp kim loại lên bề mặt vật thể bằng phương pháp điện phân. Quá trình này giúp tăng độ bền, chống ăn mòn và tính thẩm mỹ cho sản phẩm.
Trong công nghiệp ô tô, các chi tiết máy thường được mạ crôm hoặc niken để chống gỉ sét. Thời gian mạ phụ thuộc vào độ dày lớp mạ cần thiết.
Các yếu tố ảnh hưởng đến chất lượng mạ điện gồm:
- Nồng độ dung dịch điện phân
- Mật độ dòng điện
- Nhiệt độ dung dịch
- Thời gian mạ
Điện phân trong điện phân tinh luyện kim loại
Điện phân tinh luyện là quá trình làm sạch kim loại thô thành kim loại tinh khiết. Kim loại thô đóng vai trò anot sẽ tan ra trong dung dịch điện phân.
Ứng dụng phổ biến nhất là tinh luyện đồng thô thành đồng tinh khiết 99,99%. Quá trình này loại bỏ các tạp chất như sắt, kẽm, chì có trong đồng thô.
Các tạp chất sẽ lắng xuống đáy bình điện phân tạo thành bùn anot. Bùn anot chứa các kim loại quý như vàng, bạc có thể thu hồi để tận dụng.
FAQ: Câu hỏi thường gặp về công thức điện phân
Điện phân là một quá trình phức tạp khiến nhiều học sinh gặp khó khăn. Tôi sẽ giải đáp những thắc mắc phổ biến nhất về chủ đề này.
Khi giảng dạy về điện phân, tôi thường nhận được nhiều câu hỏi liên quan đến độ chính xác của phép đo. Để tính toán chính xác, các em cần nắm vững công thức tính sai số và áp dụng đúng phương pháp. công thức tính sai số
Một vấn đề quan trọng khác là hiểu rõ về từ trường sinh ra trong quá trình điện phân. Công thức hệ số tự cảm giúp xác định được độ lớn của từ trường này. công thức hệ số tự cảm
Điện trường đóng vai trò then chốt trong quá trình điện phân. Cách tính điện trường đều giúp các em hiểu rõ hơn về sự phân bố điện tích. cách tính điện trường đều
Trong các phản ứng điện phân, áp suất cũng là một yếu tố ảnh hưởng quan trọng. Công thức đẳng áp giúp tính toán chính xác các thông số liên quan. công thức đẳng áp là gì
Việc nắm vững các công thức điện phân giúp học sinh hiểu rõ bản chất của quá trình điện phân. Các phản ứng điện phân tuân theo quy luật rõ ràng và có thể áp dụng cho nhiều loại dung dịch khác nhau. Kiến thức này có ý nghĩa quan trọng trong học tập và ứng dụng thực tiễn như mạ điện, luyện kim và tinh luyện kim loại. Các công thức điện phân cơ bản tạo nền tảng vững chắc để tiếp thu kiến thức hóa học nâng cao.
Bài viết liên quan

Thông tin công thức điện trường đều và cách tính các đại lượng cơ bản
Tìm hiểu công thức điện trường đều và các đại lượng liên quan như cường độ, lực điện, điện thế. Hướng dẫn chi tiết cách tính toán kèm ví dụ thực tế cho học sinh dễ hiểu.

Nắm rõ công thức tính công suất điện và ứng dụng thực tiễn
Tìm hiểu công thức tính công suất điện với các phương pháp đo lường và ứng dụng trong mạch điện một pha, ba pha. Hướng dẫn chi tiết cách tính công suất tiêu thụ điện gia đình.

Công thức tính hiệu suất truyền tải điện và cách tính tổn thất điện năng
Tìm hiểu công thức tính hiệu suất truyền tải điện qua phân tích các yếu tố ảnh hưởng, tổn thất điện năng và phương pháp cải thiện hiệu quả đường dây điện trong thực tế.

Tổng quan công thức áp suất khí quyển và ứng dụng trong thực tiễn
Tìm hiểu công thức áp suất khí quyển qua các khái niệm cơ bản, phương pháp đo lường và ứng dụng thực tiễn. Bài học chi tiết về đơn vị đo, giá trị chuẩn và biến đổi áp suất.

Nắm rõ công thức tính số vòng dây n và ứng dụng trong điện từ học
Tìm hiểu công thức tính số vòng dây n trong điện từ học, máy biến áp và động cơ điện. Hướng dẫn chi tiết cách áp dụng công thức n1/n2 = u1/u2 với các ví dụ thực tế.

Kiến thức về công thức máy phát điện xoay chiều và cách tính toán
Tìm hiểu chi tiết các công thức máy phát điện xoay chiều, nguyên lý hoạt động và cách tính toán các đại lượng điện cơ bản như suất điện động, tần số, công suất cho học sinh phổ thông.

