Hiểu rõ công thức tính năng lượng ion hóa và quy luật biến thiên
Công thức tính năng lượng ion hóa giúp xác định mức năng lượng cần thiết để tách electron. Các yếu tố như bán kính nguyên tử và điện tích hạt nhân ảnh hưởng trực tiếp đến giá trị này. Bài viết phân tích chi tiết đặc điểm ion hóa của kim loại và phi kim kèm bảng tra cứu đầy đủ.
Năng lượng ion hóa là gì và công thức tính năng lượng ion hóa
Năng lượng ion hóa là năng lượng cần thiết để tách một electron ra khỏi nguyên tử ở trạng thái cơ bản, tạo thành ion dương. Quá trình này diễn ra trong pha khí.
Khi một nguyên tử mất electron, nó sẽ biến thành ion mang điện tích dương. Quá trình này đòi hỏi một lượng năng lượng nhất định, được gọi là năng lượng ion hóa thứ nhất.
Công thức tính năng lượng ion hóa được biểu diễn như sau:
X + Ei → X+ + e-
Trong đó:
- X là nguyên tử ban đầu
- Ei là năng lượng ion hóa
- X+ là ion dương được tạo thành
- e
- là electron bị tách ra
Năng lượng ion hóa thường được tính bằng đơn vị electron volt (eV) hoặc kJ/mol. Giá trị này phụ thuộc vào cấu trúc electron của nguyên tử.
Trong quá trình giảng dạy, tôi thường ví von năng lượng ion hóa giống như “chi phí ly hôn”
- năng lượng cần bỏ ra để tách electron ra khỏi “gia đình nguyên tử”. Cách ví von này giúp học sinh dễ nhớ và hiểu bản chất của khái niệm.
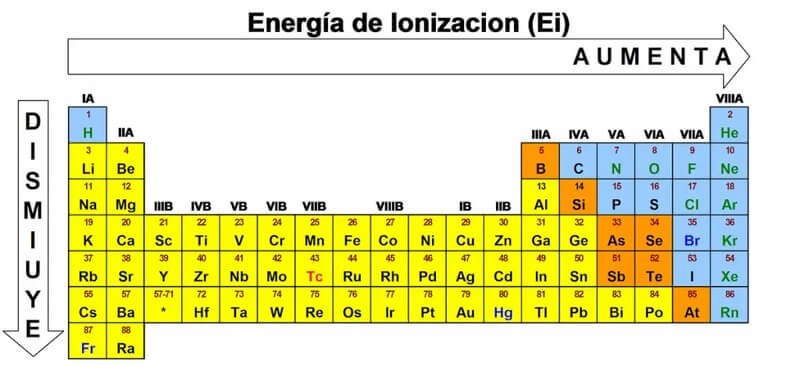
Một điểm quan trọng cần lưu ý là năng lượng ion hóa tăng dần từ trái sang phải trong chu kỳ và giảm dần từ trên xuống dưới trong nhóm của bảng tuần hoàn.
Các yếu tố ảnh hưởng đến năng lượng ion hóa của nguyên tử
Năng lượng ion hóa của nguyên tử phụ thuộc vào nhiều yếu tố khác nhau. Ba yếu tố chính quyết định giá trị này là bán kính nguyên tử, điện tích hạt nhân hiệu dụng và cấu hình electron.
Việc hiểu rõ các yếu tố này giúp dự đoán xu hướng biến đổi năng lượng ion hóa trong bảng tuần hoàn. Điều này rất quan trọng khi công thức tính năng lượng điện từ được áp dụng.
Bán kính nguyên tử
Bán kính nguyên tử có mối quan hệ tỷ lệ nghịch với năng lượng ion hóa. Khi bán kính nguyên tử càng lớn, lực hút giữa hạt nhân và electron càng yếu.
Trong quá trình giảng dạy, tôi thường ví von điều này giống như việc giữ một sợi dây. Khi sợi dây càng dài, lực kéo càng yếu và dễ đứt hơn.
Điều này giải thích tại sao các nguyên tố có bán kính nguyên tử nhỏ thường có năng lượng ion hóa lớn hơn các nguyên tố cùng chu kỳ có bán kính lớn hơn.
Điện tích hạt nhân hiệu dụng
Điện tích hạt nhân hiệu dụng là lực hút thực tế mà electron ngoài cùng cảm nhận được từ hạt nhân. Giá trị này phụ thuộc vào số proton trong hạt nhân và hiệu ứng chắn của các electron bên trong.
Khi điện tích hạt nhân hiệu dụng tăng, lực hút electron về phía hạt nhân mạnh hơn. Điều này làm tăng năng lượng cần thiết để tách electron ra khỏi nguyên tử.
Trong thực tế giảng dạy, tôi thường lấy ví dụ về các nguyên tố nhóm IA. Từ Li đến Cs, điện tích hạt nhân hiệu dụng giảm dần nên năng lượng ion hóa cũng giảm theo.
Cấu hình electron
Cấu hình electron ảnh hưởng trực tiếp đến độ bền của electron ngoài cùng. Electron ở phân lớp đã bão hòa thường bền vững và khó bị tách ra.
Nguyên tử có cấu hình electron ns2 np6 (khí hiếm) có năng lượng ion hóa rất cao. Ngược lại, nguyên tử có một electron độc thân ns1 dễ bị ion hóa hơn.

Kinh nghiệm cho thấy học sinh thường nhớ tốt hơn khi liên hệ với các nguyên tố quen thuộc. Ví dụ He (1s2) có năng lượng ion hóa cao nhất, trong khi Cs (6s1) có năng lượng ion hóa thấp nhất.
So sánh năng lượng ion hóa giữa kim loại và phi kim
Năng lượng ion hóa là năng lượng cần thiết để tách electron ra khỏi nguyên tử. Mức độ năng lượng ion hóa phản ánh khả năng giữ electron của nguyên tử.
Khi nghiên cứu về năng lượng ion hóa của kim loại, ta thấy kim loại thường có xu hướng nhường electron. Điều này liên quan trực tiếp đến công thức tính lực tương tác giữa 2 điện tích khi electron bị tách khỏi nguyên tử.
Ngược lại, năng lượng ion hóa của phi kim thường cao hơn nhiều so với kim loại. Phi kim có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm.
Đặc điểm năng lượng ion hóa của kim loại
Kim loại có năng lượng ion hóa thấp do các electron hóa trị ở lớp ngoài cùng liên kết yếu với hạt nhân. Điều này khiến kim loại dễ dàng nhường electron.
Năng lượng ion hóa của kim loại giảm dần theo chu kỳ từ trái sang phải. Nguyên nhân là do bán kính nguyên tử tăng, lực hút hạt nhân với electron ngoài cùng yếu dần.
Trong cùng nhóm, năng lượng ion hóa của kim loại giảm từ trên xuống dưới. Electron hóa trị càng xa hạt nhân thì càng dễ bị tách ra.
Đặc điểm năng lượng ion hóa của phi kim
Phi kim có năng lượng ion hóa cao vì electron hóa trị liên kết mạnh với hạt nhân. Điều này tạo nên tính chất đặc trưng của phi kim là khó nhường electron.
Trong cùng chu kỳ, năng lượng ion hóa tăng dần từ trái sang phải. Nguyên nhân là do bán kính nguyên tử giảm, lực hút hạt nhân với electron tăng.
Các phi kim ở nhóm VIIA như F, Cl, Br, I có năng lượng ion hóa rất cao. Chúng chỉ thiếu 1 electron để đạt cấu hình electron bền vững.
Bảng so sánh chi tiết
Năng lượng ion hóa thứ nhất (kJ/mol):
- Kim loại kiềm (Na): 495,8
- Kim loại kiềm thổ (Mg): 737,7
- Phi kim nhóm VIA (O): 1313,9
- Phi kim nhóm VIIA (F): 1681,0
Xu hướng biến thiên:
- Kim loại: Giảm theo chu kỳ từ trái sang phải
- Phi kim: Tăng theo chu kỳ từ trái sang phải
Khả năng tách electron:
- Kim loại: Dễ nhường electron
- Phi kim: Khó nhường electron, thường nhận thêm electron
Quy luật biến thiên năng lượng ion hóa trong bảng tuần hoàn
Năng lượng ion hóa là năng lượng cần thiết để tách electron ra khỏi nguyên tử ở trạng thái cơ bản. Đây là một đặc trưng quan trọng của nguyên tử, phản ánh khả năng giữ electron của nguyên tử đó.
Khi nghiên cứu về năng lượng ion hóa, chúng ta cần nắm được quy luật biến thiên theo chu kỳ và nhóm. Điều này giúp dự đoán được tính chất hóa học của các nguyên tố.
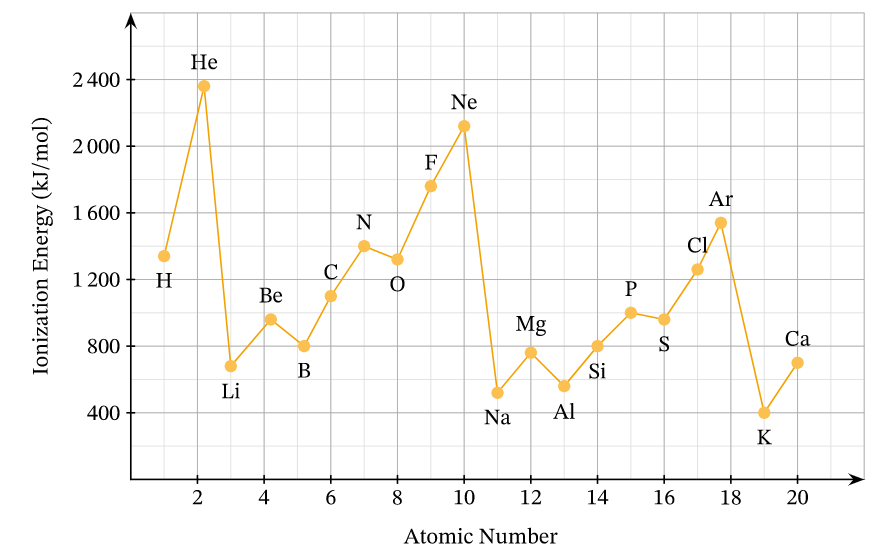
Xu hướng tăng giảm theo chu kỳ
Trong cùng một chu kỳ, năng lượng ion hóa tăng dần từ trái sang phải. Nguyên nhân là do điện tích hạt nhân tăng dần, trong khi số lớp electron không đổi.
Tôi thường ví von với học sinh rằng electron giống như những đứa trẻ, càng gần cha mẹ (hạt nhân) thì càng khó tách ra. công thức năng lượng dao động sẽ giúp các em hiểu rõ hơn về mối quan hệ này.
Tuy nhiên có một số ngoại lệ như giữa Be và B, N và O do cấu hình electron đặc biệt. Điều này khiến năng lượng ion hóa không tuân theo quy luật chung.
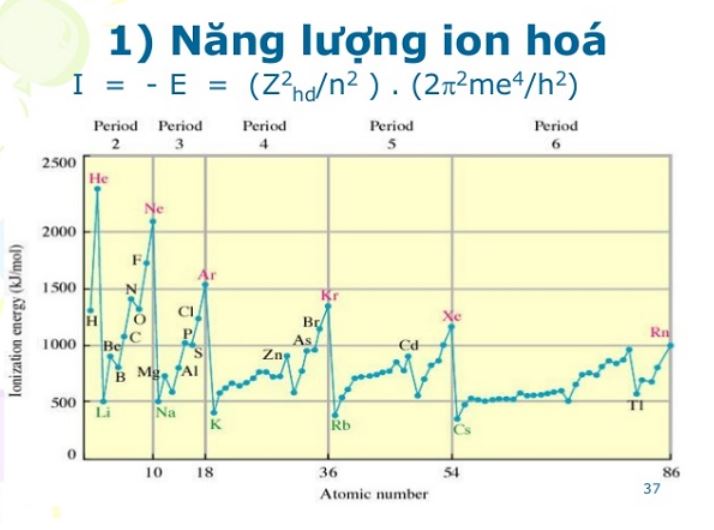
Xu hướng tăng giảm theo nhóm
Trong cùng một nhóm, năng lượng ion hóa giảm dần từ trên xuống dưới. Nguyên nhân chính là do khoảng cách từ electron ngoài cùng đến hạt nhân tăng dần.
Qua 20 năm giảng dạy, tôi nhận thấy học sinh dễ nhớ quy luật này khi liên hệ với thực tế: Càng xa trung tâm (hạt nhân), lực hút càng yếu nên electron dễ bị tách ra hơn.
Các electron ở lớp trong sẽ che chắn lực hút của hạt nhân lên electron lớp ngoài. Hiệu ứng che chắn này càng mạnh khi đi xuống dưới trong nhóm.
Bảng tra cứu năng lượng ion hóa của các nguyên tố hóa học
Bảng năng lượng ion hóa là công cụ quan trọng giúp tra cứu năng lượng cần thiết để tách electron ra khỏi nguyên tử. Bảng được sắp xếp theo số thứ tự nguyên tử tăng dần từ trái sang phải.
Việc nắm vững các giá trị năng lượng ion hóa giúp dự đoán khả năng phản ứng của nguyên tố. Các giá trị này có mối liên hệ chặt chẽ với công thức năng lượng photon khi electron bị kích thích.
Trong quá trình giảng dạy, tôi thường liên hệ năng lượng ion hóa với công thức tính năng lượng hoạt hóa để học sinh hiểu sâu hơn về phản ứng hóa học.
Năng lượng ion hóa thứ nhất của các nguyên tố
Năng lượng ion hóa thứ nhất là năng lượng tối thiểu để tách electron ngoài cùng khỏi nguyên tử trung hòa. Giá trị này phụ thuộc vào cấu trúc electron của nguyên tử.
Các kim loại kiềm có năng lượng ion hóa thấp nhất do chỉ có 1 electron ở lớp ngoài cùng. Ngược lại, khí hiếm có năng lượng ion hóa cao nhất vì cấu hình electron bền vững.
Khi giải bài tập về công thức tính xung lượng, tôi thường nhắc học sinh liên hệ với năng lượng ion hóa để hiểu rõ hơn về sự tương tác giữa các hạt.
Năng lượng ion hóa bậc cao
Năng lượng ion hóa của các nguyên tố tăng dần theo bậc ion hóa. Năng lượng ion hóa bậc 2 luôn cao hơn bậc 1 do phải tách electron từ ion dương.
Việc tách các electron ở các lớp trong đòi hỏi năng lượng rất lớn. Điều này giải thích tại sao các ion đa điện tích dương khó hình thành trong tự nhiên.
Kinh nghiệm của tôi khi dạy phần này là cho học sinh so sánh năng lượng ion hóa các bậc của cùng một nguyên tố. Cách này giúp các em hiểu rõ quy luật tăng dần của năng lượng ion hóa.
FAQ: Câu hỏi thường gặp về năng lượng ion hóa
Các câu hỏi thường gặp về năng lượng ion hóa giúp làm rõ những khái niệm cơ bản và ứng dụng thực tế. Tôi sẽ giải đáp chi tiết từng vấn đề quan trọng.
Tại sao năng lượng ion hóa thứ hai luôn lớn hơn thứ nhất?
Nguyên nhân chính là do lực hút tĩnh điện giữa hạt nhân và electron tăng mạnh sau lần ion hóa đầu tiên. Khi một electron bị tách ra, ion dương được tạo thành sẽ có lực hút mạnh hơn với các electron còn lại.
Ví dụ với nguyên tử Na, năng lượng ion hóa thứ nhất là 496 kJ/mol và thứ hai là 4562 kJ/mol. Sự chênh lệch này cho thấy việc tách electron thứ hai khó khăn hơn rất nhiều.
Mối liên hệ giữa năng lượng ion hóa và tính kim loại?
Năng lượng ion hóa có mối quan hệ nghịch với tính kim loại của nguyên tố. Kim loại thường có năng lượng ion hóa thấp vì dễ nhường electron để tạo ion dương.
Điều này giải thích tại sao các kim loại kiềm như Na, K có tính kim loại mạnh nhất. Chúng có năng lượng ion hóa thấp nhất trong bảng tuần hoàn.
Cách xác định năng lượng ion hóa thực nghiệm?
Phương pháp quang phổ khối là cách phổ biến để đo năng lượng ion hóa. Nguyên tử được chiếu tia có năng lượng tăng dần cho đến khi electron bứt ra.
Năng lượng tối thiểu cần thiết để tách electron chính là năng lượng ion hóa. Phương pháp này đòi hỏi thiết bị chuyên dụng và kỹ thuật viên có kinh nghiệm.
Trong quá trình giảng dạy, tôi thường cho học sinh thực hành với phần mềm mô phỏng trước khi tiến hành thí nghiệm thực tế. Điều này giúp các em hiểu rõ nguyên lý và quy trình đo.
Việc tính toán công thức tính năng lượng ion hóa đóng vai trò quan trọng trong hóa học. Các yếu tố như bán kính nguyên tử, điện tích hạt nhân và cấu hình electron tác động trực tiếp đến giá trị năng lượng này. Kim loại và phi kim có đặc điểm ion hóa khác biệt, tuân theo quy luật biến thiên trong bảng tuần hoàn. Giáo viên cần hướng dẫn học sinh nắm vững công thức và các yếu tố ảnh hưởng để giải quyết bài tập hiệu quả.
Bài viết liên quan

Khái quát công thức định luật phóng xạ và các ứng dụng thực tiễn
Tìm hiểu chi tiết công thức định luật phóng xạ với các thành phần cơ bản, cách tính số hạt nhân, độ phóng xạ và ứng dụng thực tế qua các ví dụ minh họa đơn giản.

Hiểu rõ công thức tính bán kính quỹ đạo dừng và ứng dụng thực tế
Tìm hiểu chi tiết công thức tính bán kính quỹ đạo dừng của electron, các yếu tố ảnh hưởng và phương pháp giải bài tập từ cơ bản đến nâng cao dành cho học sinh phổ thông.

Tổng quan công thức tính khối lượng hạt nhân và cách áp dụng cơ bản
Tìm hiểu công thức tính khối lượng hạt nhân và cách áp dụng trong hóa học. Hướng dẫn chi tiết phương pháp tính toán, các thành phần cấu tạo và mối quan hệ với khối lượng nguyên tử.

Tìm hiểu công thức tính entropy và ứng dụng trong nhiệt động lực học
Tìm hiểu chi tiết công thức tính entropy qua các dạng bài tập cơ bản trong nhiệt động lực học. Giải thích khái niệm, ý nghĩa vật lý và phương pháp áp dụng công thức entropy hiệu quả.

Công thức tính hằng số phóng xạ và các ứng dụng trong phản ứng hạt nhân
Tìm hiểu công thức tính hằng số phóng xạ và các thành phần liên quan. Hướng dẫn chi tiết cách xác định chu kỳ bán rã, hoạt độ, khối lượng chất phóng xạ kèm ví dụ thực tế.

Kiến thức về công thức tính năng lượng hoạt hóa trong phản ứng hóa học
Tìm hiểu công thức tính năng lượng hoạt hóa và các yếu tố ảnh hưởng đến tốc độ phản ứng. Giải thích chi tiết về phương trình Arrhenius, vai trò xúc tác và mối liên hệ với hằng số tốc độ.

