Kiến thức về công thức tính năng lượng hoạt hóa trong phản ứng hóa học
Công thức tính năng lượng hoạt hóa giúp xác định năng lượng tối thiểu cần thiết cho phản ứng hóa học. Các phương pháp tính toán dựa trên phương trình Arrhenius và hằng số tốc độ phản ứng. Xúc tác đóng vai trò quan trọng trong việc điều chỉnh năng lượng hoạt hóa của phản ứng.
Công thức tính năng lượng hoạt hóa trong phản ứng hóa học
Năng lượng hoạt hóa là năng lượng tối thiểu cần thiết để phản ứng hóa học xảy ra. Đây là một khái niệm quan trọng trong động hóa học.
Công thức tính năng lượng hoạt hóa được biểu diễn qua phương trình Arrhenius:
k = A.e^(-Ea/RT)
Trong đó:
- k: Hằng số tốc độ phản ứng
- A: Hệ số tần suất (hằng số Arrhenius)
- Ea: Năng lượng hoạt hóa (J/mol)
- R: Hằng số khí (8,314 J/mol.K)
- T: Nhiệt độ tuyệt đối (K)
Từ kinh nghiệm giảng dạy, tôi thường hướng dẫn học sinh biến đổi công thức trên thành dạng logarit:
ln k = ln A
Dạng này giúp tính toán đơn giản hơn khi biết các giá trị k ở các nhiệt độ khác nhau. Việc xác định năng lượng hoạt hóa trong phản ứng hóa học có ý nghĩa quan trọng trong nghiên cứu cơ chế phản ứng.
Khi nghiên cứu về năng lượng hoạt hóa, chúng ta cần hiểu rõ về công thức tính nhiệt hóa hơi vì hai khái niệm này có mối liên hệ chặt chẽ trong nhiệt động lực học.
Một ví dụ thực tế: Phản ứng phân hủy H2O2 có Ea = 75 kJ/mol ở 25°C. Khi thêm xúc tác MnO2, Ea giảm xuống còn 58 kJ/mol, giúp phản ứng diễn ra nhanh hơn nhiều lần.
Khái niệm và vai trò của năng lượng hoạt hóa
Năng lượng hoạt hóa đóng vai trò then chốt trong các phản ứng hóa học. Nó quyết định tốc độ phản ứng và khả năng xảy ra của phản ứng.
Tôi thường ví năng lượng hoạt hóa như “rào cản năng lượng”. Các chất phản ứng cần vượt qua rào cản này để tạo thành sản phẩm.
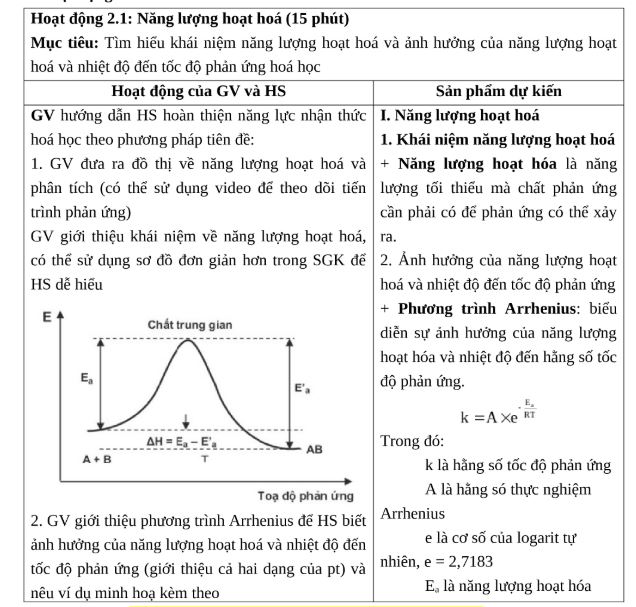
Năng lượng hoạt hóa là gì và ý nghĩa
Năng lượng hoạt hóa là mức năng lượng tối thiểu cần thiết để phản ứng hóa học có thể xảy ra. Nó được ký hiệu là Ea và đơn vị tính là kJ/mol.
Khi giảng dạy, tôi thường lấy ví dụ về quả bóng lăn trên đồi. Quả bóng cần một lực đẩy ban đầu để vượt qua đỉnh đồi và lăn xuống. Lực đẩy này chính là năng lượng hoạt hóa.
Ý nghĩa của năng lượng hoạt hóa thể hiện qua việc xác định khả năng xảy ra phản ứng. Phản ứng có Ea càng thấp càng dễ xảy ra và ngược lại.
Mối quan hệ giữa năng lượng hoạt hóa và tốc độ phản ứng
Năng lượng hoạt hóa và tốc độ phản ứng có mối quan hệ nghịch. Ea càng lớn, tốc độ phản ứng càng chậm.
Mối quan hệ này được thể hiện qua phương trình Arrhenius:
k = A.e^(-Ea/RT)
Trong đó:
- k: hằng số tốc độ phản ứng
- A: hằng số tần suất va chạm
- R: hằng số khí lý tưởng
- T: nhiệt độ tuyệt đối
Ảnh hưởng của nhiệt độ đến năng lượng hoạt hóa
Năng lượng hoạt hóa và nhiệt độ có mối liên hệ chặt chẽ. Khi tăng nhiệt độ, số phân tử có đủ năng lượng vượt qua Ea tăng lên.
Như công thức dao động điều hòa cho thấy, nhiệt độ ảnh hưởng trực tiếp đến động năng phân tử.
Kinh nghiệm giảng dạy cho thấy việc tăng nhiệt độ 10°C có thể làm tăng tốc độ phản ứng lên 2-4 lần. Điều này giải thích tại sao nhiều phản ứng cần gia nhiệt để xảy ra.
Các phương pháp xác định năng lượng hoạt hóa
Năng lượng hoạt hóa đóng vai trò quan trọng trong động học phản ứng hóa học. Nó quyết định tốc độ phản ứng và khả năng vượt qua rào cản năng lượng của các phân tử phản ứng.
Có nhiều phương pháp để xác định cách tính năng lượng hoạt hóa của một phản ứng. Phương pháp phổ biến nhất là sử dụng phương trình Arrhenius và đo tốc độ phản ứng ở các nhiệt độ khác nhau.
Phương trình Arrhenius và cách tính năng lượng hoạt hóa
Phương trình Arrhenius mô tả mối quan hệ giữa hằng số tốc độ k và nhiệt độ T:
k = A.e^(-Ea/RT)
Trong đó:
- k là hằng số tốc độ
- A là hệ số tần suất
- Ea là năng lượng hoạt hóa trong phương trình Arrhenius
- R là hằng số khí (8,314 J/mol.K)
- T là nhiệt độ tuyệt đối (K)
Để tính năng lượng hoạt hóa, ta cần đo k ở ít nhất 2 nhiệt độ khác nhau rồi áp dụng công thức định luật bảo toàn động lượng.
Mối liên hệ giữa năng lượng hoạt hóa và hằng số tốc độ
Năng lượng hoạt hóa và hằng số tốc độ có mối quan hệ nghịch biến. Khi năng lượng hoạt hóa càng lớn, hằng số tốc độ càng nhỏ và phản ứng diễn ra chậm.
Điều này giải thích tại sao nhiều phản ứng không tự xảy ra ở nhiệt độ thường. Năng lượng hoạt hóa cao khiến các phân tử khó vượt qua rào cản năng lượng để phản ứng với nhau.
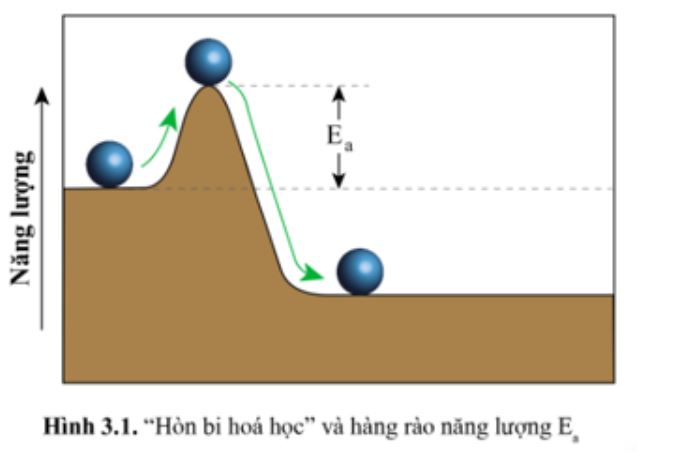
Trong thực tế giảng dạy, tôi thường ví von năng lượng hoạt hóa như “ngọn núi” mà các phân tử phải vượt qua để phản ứng được với nhau.
Vai trò của xúc tác trong việc giảm năng lượng hoạt hóa
Năng lượng hoạt hóa và xúc tác có mối liên hệ chặt chẽ. Xúc tác làm giảm năng lượng hoạt hóa bằng cách tạo ra con đường phản ứng mới thuận lợi hơn.
Giống như việc công thức tính năng lượng ion hóa cho thấy năng lượng cần thiết để ion hóa nguyên tử, xúc tác giúp giảm năng lượng cần thiết cho phản ứng.
Trong cơ thể sống, enzyme đóng vai trò xúc tác sinh học. Chúng giúp các phản ứng sinh hóa diễn ra nhanh hơn gấp hàng triệu lần so với không có enzyme.
FAQ: Câu hỏi thường gặp về năng lượng hoạt hóa
Năng lượng hoạt hóa đóng vai trò quan trọng trong phản ứng hóa học. Các câu hỏi dưới đây sẽ giúp hiểu rõ hơn về khái niệm này.
Làm thế nào để giảm năng lượng hoạt hóa của phản ứng?
Để giảm năng lượng hoạt hóa, chúng ta có thể sử dụng chất xúc tác. Chất xúc tác tạo ra con đường phản ứng mới với công thức tính năng lượng hoạt hóa thấp hơn.
Việc tăng nhiệt độ cũng giúp các phân tử vượt qua được năng lượng hoạt hóa dễ dàng hơn. Nhiệt độ cao làm tăng động năng của phân tử.
Ngoài ra, tăng diện tích tiếp xúc giữa các chất phản ứng bằng cách nghiền nhỏ hoặc khuấy trộn cũng là phương pháp hiệu quả.
Tại sao cần xác định năng lượng hoạt hóa?
Xác định năng lượng hoạt hóa giúp dự đoán tốc độ phản ứng. Giá trị này cho biết mức năng lượng tối thiểu cần thiết để phản ứng xảy ra.
Trong công nghiệp, việc biết năng lượng hoạt hóa giúp tối ưu điều kiện phản ứng. Từ đó tiết kiệm chi phí sản xuất và năng lượng tiêu thụ.
Các nhà khoa học dựa vào năng lượng hoạt hóa để nghiên cứu cơ chế phản ứng và thiết kế chất xúc tác phù hợp.
Mối quan hệ giữa năng lượng hoạt hóa và chiều của phản ứng
Năng lượng hoạt hóa của phản ứng thuận và nghịch có mối liên hệ chặt chẽ. Phản ứng nào có năng lượng hoạt hóa thấp hơn sẽ xảy ra dễ dàng hơn.
Chênh lệch năng lượng hoạt hóa giữa phản ứng thuận và nghịch chính là hiệu ứng nhiệt của phản ứng. Điều này quyết định chiều ưu tiên của phản ứng.
Trong điều kiện thường, phản ứng sẽ diễn ra theo chiều có năng lượng hoạt hóa thấp hơn. Đây là nguyên lý quan trọng trong động học phản ứng.
Việc áp dụng công thức tính năng lượng hoạt hóa đóng vai trò then chốt trong nghiên cứu động học phản ứng. Thông qua phương trình Arrhenius, các nhà khoa học xác định được mối quan hệ giữa tốc độ phản ứng và nhiệt độ. Xúc tác giúp giảm năng lượng hoạt hóa, tăng hiệu quả phản ứng và kiểm soát được quá trình chuyển hóa. Kiến thức này tạo nền tảng vững chắc cho việc nghiên cứu và ứng dụng hóa học trong thực tiễn.
Bài viết liên quan

Hiểu rõ công thức tính năng lượng ion hóa và quy luật biến thiên
Tìm hiểu chi tiết công thức tính năng lượng ion hóa, các yếu tố ảnh hưởng và quy luật biến thiên trong bảng tuần hoàn. Bao gồm bảng tra cứu và so sánh giữa kim loại, phi kim.

Khái quát công thức định luật phóng xạ và các ứng dụng thực tiễn
Tìm hiểu chi tiết công thức định luật phóng xạ với các thành phần cơ bản, cách tính số hạt nhân, độ phóng xạ và ứng dụng thực tế qua các ví dụ minh họa đơn giản.

Hiểu rõ công thức tính bán kính quỹ đạo dừng và ứng dụng thực tế
Tìm hiểu chi tiết công thức tính bán kính quỹ đạo dừng của electron, các yếu tố ảnh hưởng và phương pháp giải bài tập từ cơ bản đến nâng cao dành cho học sinh phổ thông.

Tổng quan công thức tính khối lượng hạt nhân và cách áp dụng cơ bản
Tìm hiểu công thức tính khối lượng hạt nhân và cách áp dụng trong hóa học. Hướng dẫn chi tiết phương pháp tính toán, các thành phần cấu tạo và mối quan hệ với khối lượng nguyên tử.

Tìm hiểu công thức tính entropy và ứng dụng trong nhiệt động lực học
Tìm hiểu chi tiết công thức tính entropy qua các dạng bài tập cơ bản trong nhiệt động lực học. Giải thích khái niệm, ý nghĩa vật lý và phương pháp áp dụng công thức entropy hiệu quả.

Công thức tính hằng số phóng xạ và các ứng dụng trong phản ứng hạt nhân
Tìm hiểu công thức tính hằng số phóng xạ và các thành phần liên quan. Hướng dẫn chi tiết cách xác định chu kỳ bán rã, hoạt độ, khối lượng chất phóng xạ kèm ví dụ thực tế.

