Học công thức đẳng nhiệt và ứng dụng trong khí lý tưởng cơ bản
Công thức đẳng nhiệt mô tả mối quan hệ nghịch biến giữa áp suất và thể tích của khí lý tưởng. Quá trình này diễn ra ở nhiệt độ không đổi. Các phương trình toán học đơn giản giúp học sinh dễ dàng tính toán và ứng dụng vào thực tế. Bài viết trình bày chi tiết công thức kèm bài tập mẫu có lời giải.
Công thức đẳng nhiệt là gì?
Công thức đẳng nhiệt là phương trình biểu diễn mối quan hệ giữa áp suất và thể tích của một lượng khí xác định ở nhiệt độ không đổi. Đây là một trong những định luật quan trọng của chất khí.

Công thức toán học của định luật đẳng nhiệt được biểu diễn:
P1V1 = P2V2 = hằng số
Trong đó:
- P1, P2: áp suất của khí ở trạng thái 1 và 2
- V1, V2: thể tích của khí ở trạng thái 1 và 2
- Nhiệt độ T giữ nguyên không đổi
Qua 20 năm giảng dạy, tôi thường ví von công thức này như một cái cân
- khi một bên tăng thì bên kia phải giảm để giữ cân bằng. Điều này giúp học sinh dễ nhớ mối quan hệ nghịch biến giữa P và V.
Ví dụ thực tế: Khi bơm xe đạp, thể tích khí trong bơm giảm xuống thì áp suất tăng lên. Ngược lại, khi xì hơi, thể tích khí tăng lên thì áp suất giảm xuống.
Để áp dụng công thức hiệu quả, cần chú ý:
- Đơn vị của P1 và P2 phải giống nhau
- Đơn vị của V1 và V2 phải giống nhau
- Nhiệt độ phải được giữ không đổi trong suốt quá trình
Phương trình đẳng nhiệt và định luật Boyle-Mariotte trong khí lý tưởng
Phương trình đẳng nhiệt mô tả mối quan hệ giữa áp suất và thể tích của khí lý tưởng khi nhiệt độ không đổi. Đây là một trong những quy luật cơ bản của nhiệt động lực học.
Để hiểu rõ hơn về phương trình này, chúng ta cần nắm vững các khái niệm và điều kiện cần thiết. Mối liên hệ với Công thức đẳng áp cũng rất quan trọng để có cái nhìn tổng quan.
Định nghĩa và điều kiện của quá trình đẳng nhiệt
Quá trình đẳng nhiệt là quá trình biến đổi trạng thái của khí khi nhiệt độ được giữ không đổi. Điều này xảy ra khi khí được đặt trong môi trường có nhiệt độ ổn định.
Trong thực tế, để đạt được quá trình này, tốc độ biến đổi phải đủ chậm. Điều này cho phép khí trao đổi nhiệt với môi trường và duy trì nhiệt độ không đổi.
Tôi thường ví von với học sinh rằng quá trình này giống như việc nén khí trong xi-lanh được ngâm trong nước đá. Nhiệt độ nước đá giúp khí luôn ở nhiệt độ không đổi.
Công thức đẳng nhiệt của khí lý tưởng
Công thức đẳng nhiệt của khí lý tưởng được biểu diễn:
P1V1 = P2V2 = hằng số
Trong đó:
- P1, V1: Áp suất và thể tích ở trạng thái 1
- P2, V2: Áp suất và thể tích ở trạng thái 2
Qua 20 năm giảng dạy, tôi nhận thấy học sinh dễ nhớ công thức này khi liên hệ với thực tế. Ví dụ khi bơm xe đạp, thể tích khí giảm thì áp suất tăng tương ứng.
Ý nghĩa vật lý của định luật Boyle-Mariotte
Định luật Boyle-Mariotte phản ánh mối quan hệ tỷ lệ nghịch giữa áp suất và thể tích của khí lý tưởng ở nhiệt độ không đổi.
Khi áp suất tăng gấp đôi, thể tích sẽ giảm một nửa và ngược lại. Điều này giải thích nhiều hiện tượng trong đời sống như nguyên lý hoạt động của bơm xe.
Định luật này có ý nghĩa quan trọng trong công nghiệp, đặc biệt trong các quá trình nén khí, thiết kế máy nén và hệ thống khí nén công nghiệp.
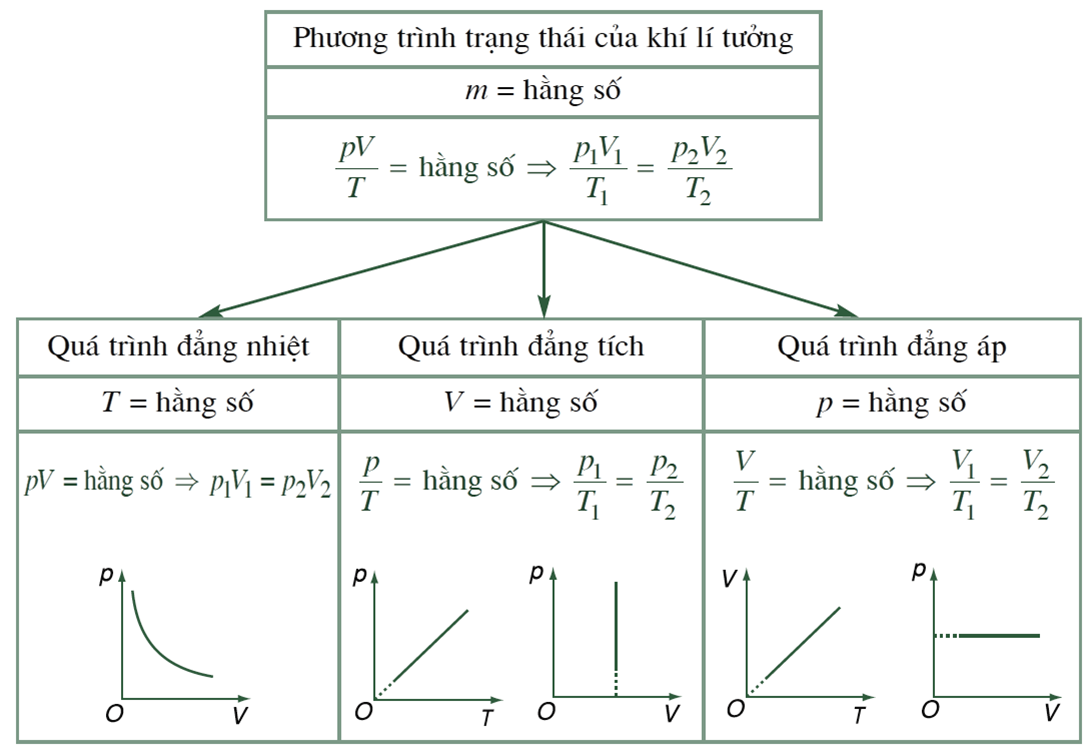
Đồ thị và đường đẳng nhiệt trong hệ tọa độ
Khi vẽ đường đẳng nhiệt trong hệ tọa độ p-V, ta thu được một đường cong hypecbol. Đường cong này thể hiện mối quan hệ giữa áp suất và thể tích của khí lý tưởng ở nhiệt độ không đổi.
Phương trình đường đẳng nhiệt được biểu diễn:
pV = nRT (với T = const)
Trong đó:
- p: áp suất của khí (Pa)
- V: thể tích của khí (m3)
- n: số mol khí
- R: hằng số khí lý tưởng
- T: nhiệt độ tuyệt đối (K)
Đặc điểm của đường đẳng nhiệt
Đồ thị đẳng nhiệt có dạng hyperbol nằm trong góc phần tư thứ nhất của hệ trục tọa độ p-V. Đường cong không cắt trục tọa độ và tiệm cận với hai trục.
Khi áp suất tăng thì thể tích giảm và ngược lại, tích số pV luôn không đổi. Điều này phản ánh định luật Boyle-Mariotte trong quá trình đẳng nhiệt.
Trong thực tế giảng dạy, tôi thường ví von đường đẳng nhiệt như một chiếc lò xo co giãn
- khi kéo dài thì lực căng giảm và khi nén lại thì lực căng tăng.
Phân tích đồ thị p-V trong quá trình đẳng nhiệt
Trên đồ thị p-V, mỗi điểm trên đường đẳng nhiệt đại diện cho một trạng thái của khí. Khi khí chuyển từ trạng thái này sang trạng thái khác, nó sẽ di chuyển dọc theo đường cong.
Diện tích giới hạn bởi đường đẳng nhiệt và trục hoành chính là công mà khí sinh ra trong quá trình giãn nở. Công này được tính bằng công thức:
A = nRT.ln(V2/V1)
Qua nhiều năm giảng dạy, tôi nhận thấy học sinh dễ nhớ công thức này khi liên hệ với logarit tự nhiên
- một hàm số quen thuộc trong toán học.
So sánh các đường đẳng nhiệt ở nhiệt độ khác nhau
Các đường đẳng nhiệt ở nhiệt độ cao nằm phía trên các đường đẳng nhiệt ở nhiệt độ thấp. Điều này phản ánh mối quan hệ tỷ lệ thuận giữa áp suất và nhiệt độ của khí.
Với cùng một thể tích, khí ở nhiệt độ cao có áp suất lớn hơn. Nguyên nhân là do động năng chuyển động nhiệt của các phân tử khí tăng theo nhiệt độ.
Khoảng cách giữa các đường đẳng nhiệt tỷ lệ với hiệu nhiệt độ giữa chúng. Đây là một đặc điểm quan trọng giúp xác định nhiệt độ của khí thông qua đồ thị p-V.
Bài tập và ví dụ về quá trình đẳng nhiệt
Quá trình đẳng nhiệt là một trong những quá trình nhiệt động cơ bản và quan trọng. Tôi sẽ phân tích chi tiết các dạng bài tập thường gặp và cách giải quyết hiệu quả.
Trước khi đi vào chi tiết, các bạn cần nắm vững Công thức đoạn nhiệt làm nền tảng để giải các bài tập phức tạp hơn.
Các dạng bài tập thường gặp
Qua hơn 20 năm giảng dạy, tôi nhận thấy có 3 dạng bài tập ví dụ về đẳng nhiệt phổ biến nhất:
Dạng 1: Tính áp suất hoặc thể tích sau khi nén/dãn đẳng nhiệt
- Cho áp suất và thể tích ban đầu
- Yêu cầu tìm một trong hai đại lượng còn lại
- Áp dụng định luật Boyle-Mariotte: P1V1 = P2V2
Dạng 2: Xác định công của quá trình đẳng nhiệt
- Cho áp suất và thể tích ban đầu/cuối
- Yêu cầu tính công A = nRTln(V2/V1)
Dạng 3: Tính nhiệt lượng trao đổi trong quá trình đẳng nhiệt
- Cho các thông số trạng thái
- Yêu cầu tính Q = -A
Phương pháp giải và lưu ý quan trọng
Khi giải các bài tập đẳng nhiệt có lời giải, tôi luôn nhắc học sinh tuân thủ 4 bước:
Bước 1: Xác định rõ điều kiện đẳng nhiệt T = const
Nhiều học sinh bỏ qua bước này dẫn đến nhầm lẫn với các quá trình khác.
Bước 2: Liệt kê đầy đủ dữ kiện
Cần ghi rõ các đại lượng đã cho và cần tìm, đơn vị phải thống nhất.
Bước 3: Lựa chọn công thức phù hợp
Tùy vào yêu cầu bài toán mà áp dụng công thức tương ứng.
Bước 4: Thực hiện tính toán và kiểm tra kết quả
Đơn vị phải đồng nhất và kết quả phải hợp lý về mặt vật lý.
Bài tập mẫu có lời giải chi tiết
Bài toán: Khí lý tưởng được nén đẳng nhiệt từ thể tích 2 lít xuống 0.5 lít. Áp suất ban đầu là 1 atm. Tính:
a) Áp suất cuối
b) Công của quá trình
Lời giải:
- Xác định điều kiện: T = const
- Dữ kiện:
- V1 = 2 lít
- V2 = 0.5 lít
- P1 = 1 atm
- P2 = ?
- A = ?
- Giải:
a) Áp dụng P1V1 = P2V2
P2 = P1V1/V2 = 1 × 2/0.5 = 4 atm
b) A = nRTln(V2/V1)
= -nRTln(4)
= -nRT × 1.386
Kết quả cho thấy công là âm do khí bị nén (V2 < V1).
Ứng dụng của quá trình đẳng nhiệt trong thực tế
Quá trình đẳng nhiệt đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau. Áp dụng đẳng nhiệt trong thực tế giúp tối ưu hóa hiệu suất và tiết kiệm năng lượng cho các hệ thống.
Việc áp dụng công thức đẳng nhiệt P1V1 = P2V2 cho phép kiểm soát chính xác áp suất và thể tích của khí trong điều kiện nhiệt độ không đổi. Điều này mang lại nhiều lợi ích thiết thực cho đời sống và sản xuất.
Ứng dụng trong công nghiệp và kỹ thuật
Trong ngành công nghiệp thực phẩm, quá trình đẳng nhiệt được sử dụng để bảo quản thực phẩm bằng cách nén khí. Áp suất cao giúp tiêu diệt vi khuẩn gây hại mà không làm thay đổi nhiệt độ.
Các nhà máy sản xuất khí công nghiệp áp dụng nguyên lý đẳng nhiệt để nén khí vào bình chứa. Quá trình này giúp tăng hiệu quả lưu trữ và vận chuyển khí.
Trong hệ thống phanh khí nén của xe tải, quá trình đẳng nhiệt đảm bảo lực phanh ổn định. Khi tài xế nhấn phanh, khí được nén với nhiệt độ không đổi tạo áp lực đều lên má phanh.
Ứng dụng trong đời sống hàng ngày
Bình ga dùng trong gia đình là ví dụ điển hình về ứng dụng quá trình đẳng nhiệt. Khi mở van, áp suất giảm làm thể tích khí tăng ở nhiệt độ không đổi.
Máy nén khí mini dùng để bơm xe đạp, xe máy cũng hoạt động dựa trên nguyên lý đẳng nhiệt. Quá trình nén diễn ra nhanh nên nhiệt độ gần như không thay đổi.
Trong y tế, các thiết bị thở oxy áp dụng quá trình đẳng nhiệt để điều chỉnh lưu lượng khí. Điều này giúp bệnh nhân nhận được lượng oxy ổn định và phù hợp.
FAQ: Câu hỏi thường gặp về công thức đẳng nhiệt
Quá trình đẳng nhiệt là một trong những quá trình nhiệt động học quan trọng. Tôi sẽ giải đáp các thắc mắc thường gặp về công thức đẳng nhiệt để giúp các em nắm vững kiến thức này.
Sự khác biệt giữa quá trình đẳng nhiệt và đoạn nhiệt
Quá trình đẳng nhiệt xảy ra khi nhiệt độ không đổi trong suốt quá trình. Hệ trao đổi nhiệt với môi trường để duy trì nhiệt độ không đổi.
Ngược lại, quá trình đoạn nhiệt là quá trình không có sự trao đổi nhiệt với môi trường. Nhiệt độ của hệ có thể thay đổi do công của lực nén hoặc dãn nở.
Điểm khác biệt quan trọng nhất là đẳng nhiệt tuân theo định luật Boyle-Mariotte, còn đoạn nhiệt tuân theo phương trình Poisson.
Mối quan hệ giữa áp suất và thể tích trong quá trình đẳng nhiệt
Trong quá trình đẳng nhiệt, áp suất và thể tích có mối quan hệ nghịch đảo:
P1V1 = P2V2 = hằng số
P là áp suất (Pa)
V là thể tích (m3)
Chỉ số 1, 2 là trạng thái đầu và cuối
Khi áp suất tăng gấp đôi thì thể tích giảm một nửa và ngược lại. Đây là một trong những quy luật dễ nhớ nhất trong nhiệt động học.
Cách xác định nhiệt độ trong quá trình đẳng nhiệt
Nhiệt độ trong quá trình đẳng nhiệt luôn không đổi:
T1 = T2 = hằng số
T là nhiệt độ tuyệt đối (K)
Để xác định nhiệt độ, ta có thể:
- Đo trực tiếp bằng nhiệt kế
- Tính từ phương trình trạng thái khí lý tưởng PV = nRT
- Sử dụng đồ thị P-V để xác định đường đẳng nhiệt
Trong thực tế giảng dạy, tôi thường gợi ý học sinh vẽ đồ thị P-V trước khi giải bài toán. Điều này giúp các em hình dung rõ hơn về quá trình đẳng nhiệt.
Việc áp dụng công thức đẳng nhiệt đóng vai trò quan trọng trong nghiên cứu và giải quyết các bài toán về khí lý tưởng. Định luật Boyle-Mariotte và các phương trình đẳng nhiệt giúp mô tả chính xác mối quan hệ giữa áp suất và thể tích của khí ở nhiệt độ không đổi. Các ứng dụng thực tiễn của quá trình đẳng nhiệt trong công nghiệp và đời sống minh chứng cho tầm quan trọng của kiến thức này trong chương trình hóa học phổ thông và đại học.
Bài viết liên quan

Học công thức khí lý tưởng và các định luật cơ bản trong hóa học
Tìm hiểu công thức khí lý tưởng và các định luật liên quan qua phương pháp giảng dạy đơn giản. Bao gồm điều kiện, đặc điểm, bài tập mẫu và hướng dẫn giải chi tiết.

Học thuộc công thức tính nhiệt nóng chảy và ứng dụng trong hóa học
Tìm hiểu công thức tính nhiệt nóng chảy và các khái niệm cơ bản về nhiệt nóng chảy riêng, đơn vị đo, bảng tra cứu các chất thông dụng. Hướng dẫn chi tiết cách tính và ứng dụng thực tế.

Công thức đoạn nhiệt khái quát và cách áp dụng trong hóa học cơ bản
Tìm hiểu chi tiết về công thức đoạn nhiệt trong hóa học với cách tính, phương pháp xác định và ứng dụng. Bài viết giải thích đơn giản các khái niệm đoạn nhiệt chuẩn, phản ứng kèm bài tập mẫu.

Điểm qua công thức tính công suất tỏa nhiệt và ứng dụng thực tế
Tìm hiểu chi tiết công thức tính công suất tỏa nhiệt trong mạch điện với các khái niệm cơ bản, công thức Q=I²Rt và ứng dụng thực tế qua bài tập có lời giải mẫu đơn giản.

Nắm kỹ công thức tính nhiệt độ tuyệt đối và cách chuyển đổi thang nhiệt
Tìm hiểu công thức tính nhiệt độ tuyệt đối và cách chuyển đổi giữa độ C, K. Giải thích chi tiết khái niệm, ứng dụng thực tế cùng bài tập minh họa về thang nhiệt Kelvin.

Điểm qua công thức đẳng áp và ứng dụng trong nhiệt động lực học
Tìm hiểu công thức đẳng áp và các đặc điểm của quá trình đẳng áp trong nhiệt động lực học. Hướng dẫn chi tiết cách tính công, ứng dụng thực tế kèm bài tập có lời giải.

