Thuộc lòng công thức tính nhiệt năng và ứng dụng trong hóa học cơ bản
Công thức tính nhiệt năng giúp xác định chính xác lượng nhiệt trong các quá trình vật lý và hóa học. Các phương pháp tính toán nhiệt năng đóng vai trò quan trọng trong nghiên cứu nhiệt động lực học. Bài viết trình bày chi tiết các công thức tính nhiệt lượng phổ biến kèm ví dụ minh họa cụ thể.
Công thức tính nhiệt năng và ứng dụng trong thực tế
Nhiệt năng là một dạng năng lượng quan trọng trong vật lý và hóa học. Nó thể hiện mức độ chuyển động của các phân tử trong vật chất.
Công thức tính nhiệt năng cơ bản được biểu diễn như sau:
Q = m.c.ΔT

Trong đó:
- Q: Nhiệt năng (đơn vị: J
- Jun)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn giữa nhiệt dung riêng và nhiệt dung mol. Nhiệt dung riêng phụ thuộc vào bản chất của vật liệu, còn nhiệt dung mol tính cho 1 mol chất.
Ví dụ thực tế: Khi đun nóng 2kg nước từ 25°C lên 100°C
- Nhiệt dung riêng của nước: c = 4200 J/kg.K
- ΔT = 100
- 25 = 75°C = 75K
Nhiệt năng có nhiều ứng dụng quan trọng trong đời sống. Các nhà máy nhiệt điện sử dụng nhiệt năng để đun nước tạo hơi nước, từ đó chuyển hóa thành điện năng phục vụ sinh hoạt.
Trong công nghiệp thực phẩm, việc tính toán nhiệt năng giúp kiểm soát chính xác nhiệt độ chế biến, đảm bảo an toàn vệ sinh thực phẩm và tiết kiệm năng lượng.
Khái niệm cơ bản về nhiệt năng và nhiệt lượng trong vật lý
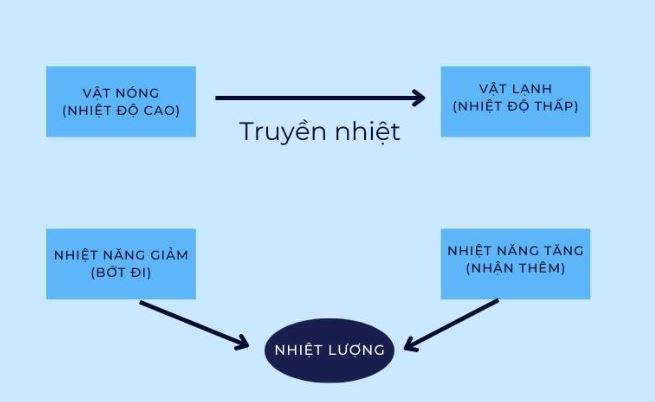
Nhiệt năng và nhiệt lượng là hai khái niệm quan trọng trong vật lý nhiệt học. Chúng có mối liên hệ mật thiết và ảnh hưởng trực tiếp đến các quá trình biến đổi năng lượng trong tự nhiên.
Để hiểu rõ hơn về hai khái niệm này, tôi sẽ phân tích chi tiết từng thành phần và mối quan hệ giữa chúng.
Nhiệt năng là gì và vai trò trong các quá trình nhiệt
Nhiệt năng là tổng động năng của các phân tử cấu tạo nên vật. Nó phụ thuộc vào nhiệt độ và khối lượng của vật.
Trong quá trình giảng dạy, tôi thường ví von nhiệt năng như “tài khoản tiết kiệm” của vật chất. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn và “số dư” trong tài khoản này cũng tăng theo.
Nhiệt năng đóng vai trò then chốt trong các quá trình trao đổi nhiệt. Nó quyết định chiều truyền nhiệt và tốc độ biến đổi nhiệt độ của vật.
Mối quan hệ giữa nhiệt năng và nhiệt lượng
Công thức tính nội năng cho thấy mối liên hệ chặt chẽ giữa nhiệt năng và nhiệt lượng. Công thức tính nhiệt lượng là Q = mcΔt, trong đó:
Q: Nhiệt lượng (J)
m: Khối lượng (kg)
c: Nhiệt dung riêng (J/kg.K)
Δt: Độ chênh lệch nhiệt độ (K)
Nhiệt lượng chính là phần năng lượng được truyền từ vật này sang vật khác do chênh lệch nhiệt độ. Khi vật nhận nhiệt lượng, nhiệt năng của nó tăng lên và ngược lại.
Các đơn vị đo nhiệt năng và nhiệt lượng thông dụng
Đơn vị SI của nhiệt năng và nhiệt lượng là Jun (J). Tuy nhiên trong thực tế, nhiều đơn vị khác cũng được sử dụng phổ biến.
Qua kinh nghiệm giảng dạy, tôi nhận thấy học sinh dễ nhớ các đơn vị quy đổi sau:
- calo (cal) = 4,18 J
- kilô calo (kcal) = 4180 J
- BTU = 1055 J
Việc nắm vững các đơn vị này giúp học sinh dễ dàng giải các bài toán chuyển đổi đơn vị trong vật lý nhiệt.
Phương pháp tính nhiệt năng và nhiệt lượng trong các bài toán
Nhiệt năng và nhiệt lượng là hai khái niệm quan trọng trong hóa học. Chúng giúp ta hiểu được sự biến đổi năng lượng trong các phản ứng.
Để tính toán chính xác công thức tính nhiệt năng, ta cần nắm vững các yếu tố cơ bản. Đó là khối lượng, nhiệt dung riêng và độ chênh lệch nhiệt độ.
Công thức tính nhiệt lượng cơ bản Q = m.c.∆t

Công thức tổng quát: Q = m.c.∆t
Trong đó:
- Q: Nhiệt lượng (J)
- m: Khối lượng chất (kg)
- c: Nhiệt dung riêng (J/kg.K)
- ∆t: Độ chênh lệch nhiệt độ (K)
Khi áp dụng công thức, cần chú ý đơn vị đo phải thống nhất. Nhiều học sinh thường nhầm lẫn giữa độ C và độ K.
Cách xác định nhiệt dung riêng của vật chất
Nhiệt dung riêng là đặc trưng của từng loại vật chất. Ta có thể xác định bằng thí nghiệm hoặc tra bảng.
Một số giá trị nhiệt dung riêng thông dụng:
- Nước: 4200 J/kg.K
- Nhôm: 900 J/kg.K
- Đồng: 380 J/kg.K
Khi tính toán các công thức nhiệt hóa hơi, việc nắm chắc các giá trị này rất quan trọng.
Ứng dụng công thức tính nhiệt lượng trong thực tế
Công thức tính nhiệt lượng được ứng dụng rộng rãi trong đời sống. Từ việc nấu ăn đến sản xuất công nghiệp.
Trong 20 năm giảng dạy, tôi thường lấy ví dụ về nồi cơm điện. Khi nấu 1kg gạo, ta cần tính được lượng nhiệt cần thiết.
Cách tính nhiệt năng chính xác giúp tiết kiệm năng lượng và tối ưu hóa quy trình sản xuất. Đây là kỹ năng thiết yếu với mọi kỹ sư hóa.
Nhiệt dung riêng và nhiệt dung mol trong tính toán nhiệt lượng
Nhiệt dung riêng và nhiệt dung mol là hai đại lượng quan trọng khi tính toán nhiệt lượng trong phản ứng hóa học. Chúng giúp xác định lượng nhiệt cần thiết để làm thay đổi nhiệt độ của một chất.
Khái niệm và ý nghĩa của nhiệt dung riêng
Nhiệt dung riêng là lượng nhiệt cần thiết để làm tăng nhiệt độ của 1kg chất lên 1°C hoặc 1K. Đơn vị của nhiệt dung riêng là J/kg.K.
Công thức tính nhiệt dung riêng:
c = Q/(m.ΔT)
Trong đó:
- c: nhiệt dung riêng (J/kg.K)
- Q: nhiệt lượng (J)
- m: khối lượng chất (kg)
- ΔT: độ chênh lệch nhiệt độ (K)
Khi giảng dạy, tôi thường lấy ví dụ về nước để học sinh dễ hiểu. Nước có nhiệt dung riêng cao nhất trong các chất thông thường (4186 J/kg.K), giúp nó trở thành chất làm mát hiệu quả.
Mối liên hệ giữa nhiệt dung riêng và nhiệt dung mol
Nhiệt dung mol và nhiệt dung riêng có mối quan hệ mật thiết thông qua khối lượng mol của chất. Khi công thức pha loãng dung dịch, ta cần chú ý đến đại lượng này.
Công thức liên hệ:
Cm = c × M
Trong đó:
- Cm: nhiệt dung mol (J/mol.K)
- c: nhiệt dung riêng (J/kg.K)
- M: khối lượng mol (kg/mol)
Bảng tra cứu nhiệt dung riêng của một số chất
Nhiệt dung riêng của các chất phụ thuộc vào nhiều yếu tố như cấu trúc phân tử và liên kết hóa học. Dưới nhiệt độ và áp suất chuẩn (25°C, 1atm):
Chất rắn:
- Nhôm: 900 J/kg.K
- Đồng: 385 J/kg.K
- Sắt: 450 J/kg.K
Chất lỏng:
- Nước: 4186 J/kg.K
- Ethanol: 2400 J/kg.K
- Dầu thực vật: 1670 J/kg.K
Kinh nghiệm của tôi cho thấy học sinh thường nhớ giá trị nhiệt dung riêng của nước làm chuẩn, từ đó so sánh với các chất khác sẽ dễ dàng hơn.
Tính nhiệt lượng trong các phản ứng hóa học
Nhiệt lượng trong phản ứng hóa học là năng lượng được trao đổi giữa hệ phản ứng và môi trường. Việc tính nhiệt lượng hóa học giúp xác định được lượng nhiệt sinh ra hoặc hấp thụ trong quá trình phản ứng.
Tương tự như điện trở suất là gì, nhiệt lượng cũng là một đại lượng vật lý quan trọng. Nó được tính theo công thức cơ bản:
Q = m.c.∆t
Trong đó:
- Q: Nhiệt lượng (J)
- m: Khối lượng chất (kg)
- c: Công thức tính nhiệt lượng riêng của chất (J/kg.K)
- ∆t: Độ chênh lệch nhiệt độ (K)
Đặc điểm của phản ứng tỏa nhiệt và thu nhiệt
Phản ứng tỏa nhiệt xảy ra khi hệ phản ứng giải phóng nhiệt ra môi trường. Nhiệt độ của môi trường tăng lên và nhiệt lượng phản ứng mang giá trị âm.
Phản ứng thu nhiệt ngược lại, hệ phản ứng hấp thụ nhiệt từ môi trường. Nhiệt độ môi trường giảm xuống và nhiệt lượng phản ứng mang giá trị dương.
Trong thực tế giảng dạy, tôi thường lấy ví dụ về phản ứng cháy của than để minh họa phản ứng tỏa nhiệt. Còn quá trình quang hợp của cây xanh là điển hình cho phản ứng thu nhiệt.

Phương pháp xác định nhiệt lượng phản ứng
Phương pháp nhiệt lượng kế là cách phổ biến nhất để xác định nhiệt lượng phản ứng. Thiết bị này gồm bình cách nhiệt chứa nước và nhiệt kế để đo nhiệt độ.
Công thức tính nhiệt lượng phản ứng:
Qph = -(m1.c1 + m2.c2).∆t
Trong đó:
- Qph: Nhiệt lượng phản ứng
- m1, m2: Khối lượng các chất tham gia
- c1, c2: Nhiệt dung riêng của các chất
- ∆t: Độ chênh lệch nhiệt độ
Ví dụ minh họa về tính nhiệt lượng trong hóa học
Bài toán: Tính nhiệt lượng tỏa ra khi hòa tan 20g NaOH vào 180g nước ở 25°C, biết nhiệt độ dung dịch tăng lên 35°C.
Giải:
Q = -(m1.c1 + m2.c2).∆t
= -(20.1,00 + 180.4,18).(35-25)
= -(20 + 752,4).10
= -7724 J
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn dấu của nhiệt lượng phản ứng. Cần nhớ: phản ứng tỏa nhiệt thì Q < 0, thu nhiệt thì Q > 0.
FAQ: Câu hỏi thường gặp về tính toán nhiệt năng
Nhiệt năng là một khái niệm quan trọng trong vật lý và hóa học. Việc tính toán chính xác nhiệt năng giúp kiểm soát các phản ứng hóa học và quá trình chuyển hóa năng lượng.
Trong quá trình giảng dạy, tôi nhận thấy học sinh thường gặp khó khăn khi tính toán nhiệt năng. Vì vậy, tôi sẽ giải đáp các câu hỏi phổ biến nhất.
Làm thế nào để tính nhiệt lượng tỏa ra khi đốt nhiên liệu?
Để tính nhiệt lượng tỏa ra khi đốt nhiên liệu, ta sử dụng công thức:
Q = m × q
Trong đó:
- Q: Nhiệt lượng tỏa ra (J)
- m: Khối lượng nhiên liệu (kg)
- q: Nhiệt năng riêng của nhiên liệu (J/kg)
Ví dụ khi đốt 2kg than có nhiệt năng riêng 29.000 kJ/kg:
Q = 2 × 29.000 = 58.000 kJ
Cách xác định nhiệt dung riêng của chất rắn và chất lỏng
Cách tính nhiệt dung riêng của vật thể dựa vào công thức:
c = Q/(m×ΔT)
Trong đó:
- c: Nhiệt dung riêng (J/kg.K)
- Q: Nhiệt lượng (J)
- m: Khối lượng (kg)
- ΔT: Độ chênh lệch nhiệt độ (K)
Khi giải các bài tập về công thức xung lượng và công thức độ tự cảm, ta cũng áp dụng nguyên tắc tương tự.
Phương pháp giải các bài tập về nhiệt năng phức tạp
Với các bài tập phức tạp, cần chia nhỏ thành các bước:
- Xác định các đại lượng đã cho
- Viết công thức tổng quát
- Thay số và tính toán từng phần
- Kiểm tra đơn vị và kết quả
Kinh nghiệm của tôi là luôn vẽ sơ đồ quá trình chuyển hóa nhiệt. Điều này giúp học sinh hình dung rõ hơn về bài toán.
Hiểu và vận dụng công thức tính nhiệt năng là nền tảng quan trọng trong việc giải các bài toán nhiệt học. Thông qua các ví dụ và bài tập thực tế, chúng ta nắm được cách xác định nhiệt năng của vật thể dựa trên khối lượng, nhiệt dung riêng và độ biến thiên nhiệt độ. Đây là kiến thức cốt lõi giúp học sinh tiếp cận tốt hơn các nội dung nâng cao trong chương trình vật lý.
Bài viết liên quan

Học công thức khí lý tưởng và các định luật cơ bản trong hóa học
Tìm hiểu công thức khí lý tưởng và các định luật liên quan qua phương pháp giảng dạy đơn giản. Bao gồm điều kiện, đặc điểm, bài tập mẫu và hướng dẫn giải chi tiết.

Học thuộc công thức tính nhiệt nóng chảy và ứng dụng trong hóa học
Tìm hiểu công thức tính nhiệt nóng chảy và các khái niệm cơ bản về nhiệt nóng chảy riêng, đơn vị đo, bảng tra cứu các chất thông dụng. Hướng dẫn chi tiết cách tính và ứng dụng thực tế.

Công thức đoạn nhiệt khái quát và cách áp dụng trong hóa học cơ bản
Tìm hiểu chi tiết về công thức đoạn nhiệt trong hóa học với cách tính, phương pháp xác định và ứng dụng. Bài viết giải thích đơn giản các khái niệm đoạn nhiệt chuẩn, phản ứng kèm bài tập mẫu.

Điểm qua công thức tính công suất tỏa nhiệt và ứng dụng thực tế
Tìm hiểu chi tiết công thức tính công suất tỏa nhiệt trong mạch điện với các khái niệm cơ bản, công thức Q=I²Rt và ứng dụng thực tế qua bài tập có lời giải mẫu đơn giản.

Nắm kỹ công thức tính nhiệt độ tuyệt đối và cách chuyển đổi thang nhiệt
Tìm hiểu công thức tính nhiệt độ tuyệt đối và cách chuyển đổi giữa độ C, K. Giải thích chi tiết khái niệm, ứng dụng thực tế cùng bài tập minh họa về thang nhiệt Kelvin.

Học công thức đẳng nhiệt và ứng dụng trong khí lý tưởng cơ bản
Tìm hiểu chi tiết công thức đẳng nhiệt và định luật Boyle-Mariotte qua các ví dụ, bài tập có lời giải. Phân tích đồ thị, ứng dụng thực tế giúp nắm vững kiến thức cơ bản.

